
中南大學湘雅基礎醫(yī)學院病理生理學系王念副教授成果在Developmental Cell發(fā)表
成麗琴 譚斯品 2025年10月28日 08:35 瀏覽次數(shù):
近期,國際權威學術期刊《Developmental Cell》在線發(fā)表中南大學湘雅基礎醫(yī)學院病理生理學系王念副教授團隊的研究成果 “A non-canonical immunometabolic function of BRD3 during sepsis”(膿毒癥中 BRD3 的非經(jīng)典免疫代謝功能)。美國西南醫(yī)學中心唐道林教授及康睿教授為本文共同通訊作者,中南大學湘雅基礎醫(yī)學院的王念副教授和廣州醫(yī)科大學附屬第三醫(yī)院的柳嬌研究員為本文的共同第一作者。
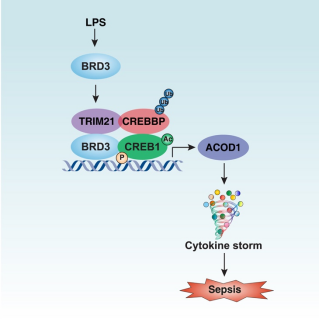
膿毒癥以宿主對病原體感染的固有免疫應答失調(diào)為特征,致死率極高,構成重大公共衛(wèi)生挑戰(zhàn),其免疫代謝調(diào)控機制尚未被充分闡明。本研究首次明確,含溴域蛋白 3(BRD3)通過非經(jīng)典途徑上調(diào)單核細胞與巨噬細胞中烏頭酸脫羧酶 1(ACOD1)的表達,在感染性休克中發(fā)揮關鍵作用。機制上,脂多糖(LPS)可觸發(fā) BRD3 與三聯(lián)基序蛋白 21(TRIM21)相互作用;TRIM21 借助其 E3 泛素連接酶活性激活 CREB 結(jié)合蛋白(CREBBP),促進 CREBBP 與環(huán)磷酸腺苷反應元件結(jié)合蛋白 1(CREB1)的結(jié)合及乙酰化修飾;隨后 BRD3 識別并磷酸化乙酰化 CREB1 的轉(zhuǎn)錄激活位點,最終驅(qū)動 ACOD1 基因轉(zhuǎn)錄上調(diào)。在四種小鼠感染模型中,骨髓細胞特異性 Brd3 基因敲除(Brd3Mye?/?)或采用小分子抑制劑 OTX015 進行干預,均能顯著減輕全身炎癥反應及器官損傷,其保護效應與 ACOD1 骨髓細胞特異性敲除(Acod1Mye?/?)小鼠一致。臨床數(shù)據(jù)進一步證實,膿毒癥患者外周血中 BRD3 水平升高與炎癥反應加劇、疾病嚴重程度增加及院內(nèi)死亡風險升高直接相關,明確 BRD3 可作為感染相關免疫失調(diào)的潛在治療靶點。
王念副教授團隊長期致力于膿毒癥多器官功能損傷的機制與干預研究,主持并參與多項國家級、省級科研課題。本研究得到中南大學湘雅基礎醫(yī)學院、膿毒癥轉(zhuǎn)化醫(yī)學湖南省重點實驗室等單位的鼎力支持。
原文鏈接:https://www.cell.com/developmental-cell/abstract/S1534-5807(25)00601-X
(一審:柳學淵 二審:黃河 三審:王寬松)
